2023年3月,我校基础医学院胡志林课题组联合上海交通大学医学院邹强研究员课题组等在国际期刊《临床研究杂志》(The Journal of Clinical Investigation)发表题为《糖酵解驱动STING信号通路促进树突状细胞抗肿瘤功能》(Glycolysis drives STING signaling to facilitate dendritic cell antitumor function)的研究论文。
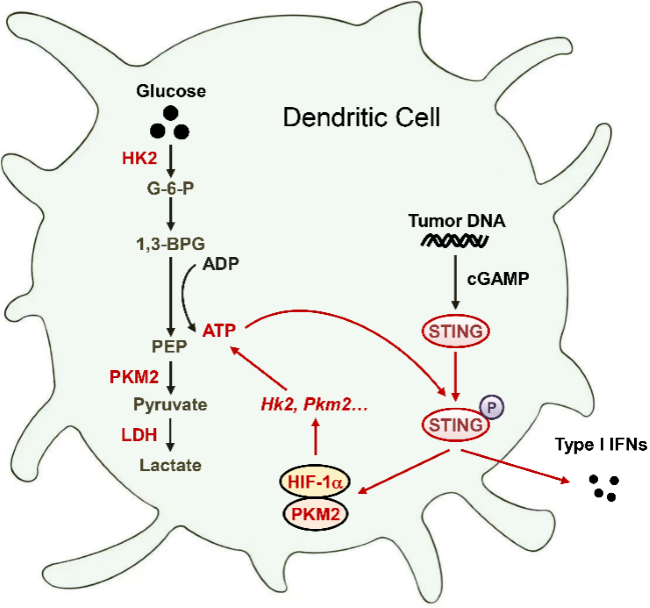
本项研究发现,在肿瘤浸润树突状细胞(DCs)中,糖酵解与干扰素基因刺激因子(stimulator of interferon genes,STING)信号通路形成正反馈调控机制,促进DCs依赖的抗肿瘤免疫功能。本项研究系统阐述糖酵解促进DCs依赖的抗肿瘤免疫应答机理,探索靶向DCs 糖酵解增强抗肿瘤免疫治疗新策略。
DCs是参与抗肿瘤免疫应答一类重要的抗原提呈细胞,能够进行抗原交叉递呈的肿瘤微环境DCs是这种反应的重要组成部分。但是,肿瘤微环境中DCs的功能往往是紊乱的。代谢异常是肿瘤微环境DCs功能紊乱的重要原因,但其调控网络尚不清楚,亟待研究。
围绕上述关键科学问题,研究人员分离外周DCs和肿瘤浸润DCs,通过转录组学发现肿瘤浸润DCs中糖酵解信号通路显著富集,并通过Seahorse实验进一步证实:肿瘤浸润DCs糖酵解代谢水平显著升高。通过代谢质谱、条件性敲除小鼠、肿瘤模型、临床样本检测等技术手段进一步证实:肿瘤微环境中DCs糖酵解代谢水平升高,快速合成ATP,促进STING信号通路活化,增强DCs抗肿瘤功能。同时STING信号通路的活化促进HIF-1a信号通路激活,上调糖酵解关键基因Hk2、Pkm2等的表达,增强糖酵解信号,两者之间形成正反馈调节机制。更为关键的是,研究人员在非小细胞肺癌患者组织DCs中也同样证实:糖酵解促进了STING依赖的DCs活性。
本项研究系统阐述糖酵解促进DCs依赖的抗肿瘤免疫应答机理:发现糖酵解增强肿瘤浸润DCs功能,促进DCs依赖的抗肿瘤免疫;阐明肿瘤浸润DCs中糖酵解信号和STING信号通路间的正反馈调节机制;探索靶向DCs 糖酵解增强抗肿瘤免疫治疗新策略。
我校基础医学院胡志林教授为论文第一作者,上海交通大学医学院邹强研究员、上海交通大学附属胸科医院呼吸内科孙加源主任医师、上海交通大学医学院附属新华医院泌尿外科崔心刚教授和我校基础医学院胡志林教授为论文共同通讯作者。
原文链接:https://www.jci.org/articles/view/166031/pdf
(供稿/胡志林课题组;审核/江胜强 陈峰 高威)

