4月4日,《癌症研究》(Cancer Research)杂志以封面文章形式在线发表公共卫生学院钱旭教授课题组最新研究成果,题为《PGC-1α降解通过抑制线粒体生物合成介导胶质瘤放疗抵抗》(PGC-1α degradation suppresses mitochondrial biogenesis to confer radiation resistance in glioma)。
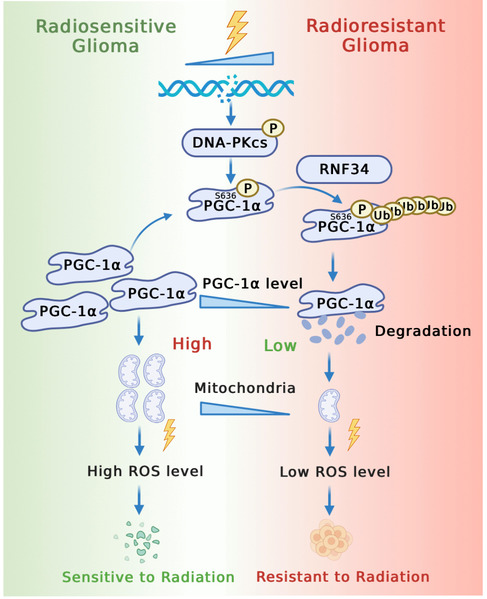
该研究发现,放疗诱导胶质瘤细胞PGC-1α蛋白的磷酸化修饰和泛素化降解,进而抑制线粒体生物合成和活性氧(ROS)的产生,从而揭示胶质瘤细胞自我保护的放疗抵抗机制,并为临床胶质瘤患者改善放疗疗效提供潜在的联合干预靶标。

胶质瘤是中枢神经系统最常见的原发恶性肿瘤,其中恶性度最高的胶质母细胞瘤(Glioblastoma, GBM)平均中位生存期不超过15个月。放射治疗作为临床常用的治疗手段之一,其疗效常常由于放疗抵抗的产生而受到限制。因此,阐明胶质瘤放疗抵抗机制,并为临床改善胶质瘤放疗疗效及患者预后提供新的治疗策略具有重要意义。
本研究首先通过分析胶质瘤组织样本和细胞的转录组测序数据,发现线粒体代谢通路活性在放疗抵抗胶质瘤中显著被抑制,并且线粒体生物合成关键调节因子PGC-1α的表达水平与胶质瘤复发风险、患者放疗疗效及临床预后显著相关。进一步研究表明,胶质瘤中线粒体含量低的细胞亚群PGC-1α表达水平降低,并对放疗呈现明显的抵抗作用。
通过深入探究其中的分子机制,本研究发现放疗诱导DNA-PK激酶对PGC-1α蛋白第636位丝氨酸进行磷酸化修饰,进而促进E3泛素连接酶RNF34对PGC-1α蛋白的泛素化降解作用。通过高表达PGC-1αS636A突变体或经PGC-1α小分子激活剂ZLN005处理,可以明显提高放疗抵抗胶质瘤细胞的放疗敏感性,增加放疗后ROS的产生和细胞凋亡,从而为改善胶质瘤放疗敏感性提供参考依据。
我校公共卫生学院赵梦洁博士和李彦慧硕士以及第一附属医院陆晨飞博士为论文共同第一作者。公共卫生学院钱旭教授、第一附属医院施祝梅副研究员以及附属脑科医院杨坤教授为本文的共同通讯作者。特别致谢基础医学院刘文涛教授及其团队朱学贤、宗丽娟等同学为本研究设计和绘制封面图片。
原文链接:https://doi.org/10.1158/0008-5472.CAN-22-3083
(素材来源/钱旭教授课题组)

